viernes, 16 de noviembre de 2007
martes, 13 de noviembre de 2007
QUIMICA ORGANICA
La configuración electrónica del átomo de un elemento corresponde a la ubicación de los electrones en los orbitales de los diferentes niveles de energía. Aunque el modelo de Scrödinger es exacto sólo para el átomo de hidrógeno, para otros átomos es aplicable el mismo modelo mediante aproximaciones muy buenas.
La manera de mostrar cómo se distribuyen los electrones en un átomo, es a través de la configuración electrónica.
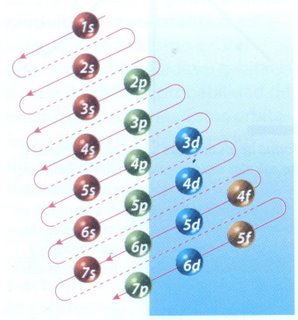
El orden en el que se van llenando los niveles de energía es: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p.
El esquema de llenado de los orbitales atómicos, lo podemos tener utilizando la regla de la diagonal, para ello debes seguir atentamente la flecha del esquema comenzando en 1s; siguiendo la flecha podrás ir completando los orbitales con los electrones en forma correcta.
Para escribir la configuración electrónica de un átomo es necesario:
- Saber el número de electrones que el átomo tiene; basta conocer el número atómico (Z) del átomo en la tabla periódica. Recuerda que el número de electrones en un átomo neutro es igual al número atómico (Z = p+).
- Ubicar los electrones en cada uno de los niveles de energía, comenzando desde el nivel más cercano al núcleo (n = 1).
- Respetar la capacidad máxima de cada subnivel (s = 2e-, p = 6e-, d = 10e- y f = 14e-).
Ejemplo:
Los orbitales se llenan en orden creciente de energía, con no más de dos electrones por orbital, según el principio de construcción de Aufbau.
Litio (Z = 3). Este elemento tiene 3 electrones. Empezaremos llenando el orbital de menor energía con dos electrones que tendrán distinto spin (ms). El electrón restante ocupará el orbital 2s, que es el siguiente con menor energía:

La flecha indica el valor del cuarto número cuántico, el de spin: para +1/2: y para –1/2, respectivamente. 
También podemos describir la distribución de electrones en el átomo de litio como: 
Los electrones que tienen números de espín opuestos cancelan los efectos magnéticos y se dice que son electrones apareados. Un ejemplo son los dos electrones que ocupan el orbital 1s en el átomo de Litio. De manera similar decimos que el electrón que ocupa el orbital 2s orbital está desapareado.
En la tabla a continuación vemos como se distribuyen los electrones de los átomos en orden creciente a su número atomico (Z):
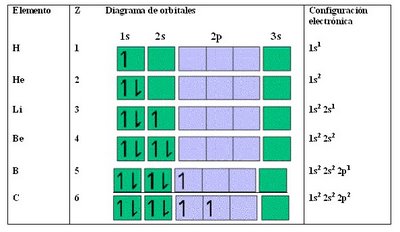
En el helio se completa el primer nivel (n=1), lo que hace que la configuración del He sea muy estable.Para el Boro el quinto electrón se sitúa en un orbital 2p y al tener los tres orbitales 2p la misma energía no importa cuál de ellos ocupa.
En el carbono el sexto electrón podría ocupar el mimo orbital que el quinto u otro distinto. La respuesta nos la da:la regla de Hund: la distribución más estable de los electrones en los subniveles es aquella que tenga el mayor número de espínes paralelos.
Los electrones se repelen entre sí y al ocupar distintos orbitales pueden situarse más lejos uno del otro. Así el carbono en su estado de mínima energía tiene dos electrones desapareados, y el nitrógeno tiene 3.
El neón completa el nivel dos y al igual que el helio tiene una configuración estable.Las configuraciones electrónicas pueden también escribirse de manera abreviada haciendo referencia al último nivel completo. Para ello, debemos ocupar la configuración de los gases nobles, ya que ellos tienen todos su orbitales completos con electrones (s2p6), como por ejemplo en el caso del helio (s2) y neon (s2p6) como se muestra en la tabla anterior.
- Así la configuración del sodio Na, la podemos escribir como [Ne]3s1
- También podemos escribir la configuración del litio como [He]2s1
A los electrones que pertenecen a un nivel incompleto se les denomina electrones de valencia.El gas noble Argón representa el final del período iniciado por el sodio para n=3
1s 2s 2p 3s 3p

Ar 18
[Ne] 3s2 3p6
En el siguiente elemento, el potasio con 19 electrones, deberíamos empezar a llenar los orbitales 3d. Sin embargo el comportamiento químico del potasio es similar al de litio y el sodio, ambos con un electrón de valencia desapareado en un orbital s, por lo que al potasio le correspondería la configuración [Ar] 4s1. Por lo tanto, el orbital 4s tendrá que tener menor energía que los orbitales 3d (el apantallamiento de los electrones en los orbitales 3d es mayor que el de los electrones en los orbitales 4s). 
Lo mismo ocurre a partir del elemento Sc (Z = 21) [Ar] 3d1 4s2. El último electrón no se agrega al subnivel 4p, sino al 3d, como lo indica el orden energético. Lo mismo sucede con las configuraciones de los emenetos Ti (Z = 22) y V (Z = 23). Con el cromo (Cr Z = 24) surge otra aparente anomalía porque su configuración es [Ar] 3d5 4s1. La lógica de llenado habría llevado a [Ar] 3d4 4s2, sin embargo la distribución fundamental correcta es la primera. Esto se debe a que el semillenado de orbitales d es de mayor estabilidad, puesto que su energía es más baja. 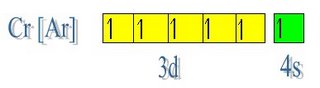
Con el cobre Cu Z = 29 sucede algo similar al cromo, pusto que su configuración fundamental es [Ar] 3d10 4s1. La configuración [Ar] 3d9 4s2 es de mayor energía. La configuración con 10 electrones en orbitales d, es decir, el llenado total de estos orbitales es más estable.
http://iiquimica.blogspot.com/2006/03/configuracin-electrnica.html
--> ENLACE QUIMICO:Un enlace químico es la unión entre dos o más átomos para formar una entidad de orden superior, como una molécula o una estructura cristalina. Para formar un enlace dos reglas deben ser cumplidas regla del dueto y la regla del octeto.
Tipos de Enlaces:
Enlace iónico: Es la unión que se produce entre dos átomos de electronegatividades distintas, con una diferencia igual o mayor a 1.67, en este tipo de enlace ocurre una transferencia de uno o más electrones del átomo menos electronegativo hacia el más electronegativo. Por ende el átomo que cedió electrones queda con carga positiva y el que capto electrones queda con carga negativa.
El enlace iónico se presenta generalmente entre los átomos de los grupos:
I A - VII A
II A - VI A
III A - V A
Enlace covalente :
Se forma entre atomos de elementos que tienen naturaleza semejante, de manera que no pierden ni ganan electrones si no que los comparte. Las reacciones entre 2 atomos no metales producen enlaces covalentes.Este tipo de enlace se produce cuando existe una electronegatividad polar.
Enlace covalente sencillo
Es cuando se comparte un par de electrones entre los atomos que forman el enlace, en otras palabras cada atomo aporta un electron.
Enlace covalente simple: Cuando un átomo comparte con otro un par de electrones uno con otros.(alcanos)
Enlace covalente doble:Cuando un atomo comparte con otro 4 electrones 2 de cada atomo(alquenos)
Enlace covalente triple: cuando un atomo comparte con otro 6 electrones 3 de cada atomo.(alquino)
Enlace de Hidrógeno: cuando un átomo de hidrógeno se encuentra entre dos átomos más electronegativos, estableciendo un vínculo entre ellos. El átomo de hidrógeno tiene una carga parcial positiva, por lo que atrae a la densidad electrónica de un átomo cercano en el espacio.

CITA BIBLIOGRAFICA
http://es.wikipedia.org/wiki/Enlace_qu%C3%ADmico
--> Tabla Periódica
La tabla periódica de los elementos es la ordenación que, atendiendo a diversos criterios, distribuye los distintos elementos químicos conforme a ciertas características.
| Grupo | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
| I | II | III | IV | V | VI | VII | VIII | ||||||||||||
| Periodo | |||||||||||||||||||
| 1 | 1 H | 2 He | |||||||||||||||||
| 2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | |||||||||||
| 3 | 11 Na | 12 Mg | 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | |||||||||||
| 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr | |
| 5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te | 53 I | 54 Xe | |
| 6 | 55 Cs | 56 Ba | * | 71 Lu | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn |
| 7 | 87 Fr | 88 Ra | ** | 103 Lr | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Uub | 113 Uut | 114 Uuq | 115 Uup | 116 Uuh | 117 Uus | 118 Uuo |
| Lantánidos | * | 57 La | 58 Ce | 59 Pr | 60 Nd | 61 Pm | 62 Sm | 63 Eu | 64 Gd | 65 Tb | 66 Dy | 67 Ho | 68 Er | 69 Tm | 70 Yb | ||
| Actínidos | ** | 89 Ac | 90 Th | 91 Pa | 92 U | 93 Np | 94 Pu | 95 Am | 96 Cm | 97 Bk | 98 Cf | 99 Es | 100 Fm | 101 Md | 102 No |
| Alcalinos | Alcalinotérreos | Lantánidos | Actínidos | Metales de transición |
| Metales del bloque p | Metaloides | No metales | Halógenos | Gases nobles |
CITA BIBLIOGRAFICA
lunes, 12 de noviembre de 2007
Anexos
Factores que determinaron el éxito de las experiencias de mendel:
1.1 la selección de las plantas utilizadas
Por ejemplo: la arveja tiene un cultivo sencillo y un crecimiento a todo tiempo
1.2 El registro de datos de cada experiencia fue minucioso y preciso:
Esto permitió registrar el tipo de descendientes en cada generación y llegar a conclusiones válidas hasta hoy.
1.3 Selección de caracteres sencillos:
Se tomo uno o dos de los caracteres para mejor precisión
1.4 El empleo de las matemáticas:
Especialmente en las probabilidades y el análisis combinatorio para analizar sus observaciones y formular una hipótesis explicatoria de cada experiencia
Lo determina un par de cromosomas sexuales que son diferentes en el varón y la mujer.
En el hombre son 46 cromosomas. 44 son conocidos como autónomas los cuales se distribuyen en 22 pares, los dos restantes son conocidos como cromosomas sexuales por ser los que determinan el sexo.
En la mujer son iguales y se le conocen como XX y en el varón son distintos, a un cromosoma se le conoce como X y a otro como Y.
Al formarse los gametos, los dos cromosomas se dividen, de tal manera que la mitad de los cromosomas espermatozoides llevan los cromosomas X y la otra mitad el cromosoma Y, en cambio los óvulos llevan un cromosoma X.
La fecundación se realiza al azar, es decir, puede efectuarla el espermatozoide de uno de los dos tipos.
Cuando se tienen descendientes las probabilidades de que se proceden varón o mujer, son iguales, por consiguiente el ser varón o mujer es un simple azar.
Un individuo se considera que es RH+ presenta un componente llamado AGLUTINOGENO, de lo contrario si no lo posee es RH-
Por estudio científico se ha comprobado que la sangre de piel negra son 100% RH+, mientras que en la población blanca el 85% es RH+ y solo el 15% es RH-.
Es muy importante saber que el factor RH+ es bien predominante y obviamente el RH- es recesivo.
4.1 caracteres patológicos llegados al cromosoma X
El cromosoma X puede ser también portador de algunos genes que van a orientar caracteres patológicos hereditarios en el nuevo individuo, como la HEMOFILIA, el Daltonismo, la Neopia y el astigmatismo.
4.1.1 La Hemofilia: es una enfermedad hereditaria que se entiende por la falta de coagulación de la sangre. La Hemofilia se hereda como carácter ligado al sexo, quien transmite la enfermedad es la madre pero no la padece. Los varones enfermos de hemofilia rara vez tienen descendencia.
RASGOS | DOMINANTE | RECESIVO |
Color de pelo | Negro | RUBIO |
Cabello | Rizado | LISO |
Mechón blanco frontal | Si | No |
Color de los ojos | Negro | Azul |
Color de la piel | Varios genes determinan el color | Aldino |
Astigmatismo | Padece | Visión normal |
Pabellón de la oreja | Desprendido | Adherido |
Labios | Gruesos | Finos |
Desarrollo del sabor | Catadores | No catadores |
Enrollamiento de la lengua | Si puede | No puede |
Grupo sanguineo | A-B AB | 0 |
Existen tres tipos de astigmatismo:
Simple: Aparece en un solo eje.
Compuesto: Idéntico al primero, solo que ahora se asocia a la miopía si los dos ejes enfocan delante de la retina, o a la hipermetropía si los dos ejes enfocan detrás.
Mixto: Cuando un eje enfoca delante de la retina y otro detrás.